תרמודינמיקה היא ענף חשוב בפיזיקה. אנו יכולים לומר בבטחה שהישגיו הובילו להופעתו של העידן הטכנולוגי וקבעו במידה רבה את מהלך ההיסטוריה האנושית ב-300 השנים האחרונות. המאמר דן בחוקים הראשון, השני והשלישי של התרמודינמיקה ויישומם בפועל.
מהי תרמודינמיקה?
לפני ניסוח חוקי התרמודינמיקה, בואו נבין מה עושה החלק הזה של הפיזיקה.
המילה "תרמודינמיקה" היא ממקור יווני ומשמעותה "תנועה עקב חום". כלומר, ענף זה של הפיזיקה עוסק בחקר תהליכים כלשהם, כתוצאה מכך אנרגיה תרמית מומרת לתנועה מכנית ולהיפך.
חוקי היסוד של התרמודינמיקה נוסחו באמצע המאה ה-19. מדע ה"תנועה והחום" רואה את התנהגות המערכת כולה כמכלול, בוחן את השינוי בפרמטרים המקרוסקופיים שלה - טמפרטורה, לחץ ונפח, ולא שם לב למבנה המיקרוסקופי שלה. יתרה מכך, הראשון שבהם ממלא תפקיד מהותי בניסוח חוקיםתרמודינמיקה בפיזיקה. מעניין לציין שהם נגזרים אך ורק מתצפיות ניסיוניות.
המושג של מערכת תרמודינמית

פירושו כל קבוצה של אטומים, מולקולות או יסודות אחרים הנחשבים כמכלול. כל שלושת החוקים מנוסחים עבור המערכת התרמודינמית כביכול. דוגמאות הן: האטמוספירה של כדור הארץ, כל אורגניזם חי, תערובת הגז במנוע בעירה פנימית וכו'.
כל המערכות בתרמודינמיקה שייכות לאחד משלושה סוגים:
- פתוח. הם מחליפים גם חום וגם חומר עם הסביבה. למשל, אם מבשלים אוכל בסיר על אש גלויה, הרי שזו דוגמה חיה למערכת פתוחה, שכן הסיר מקבל אנרגיה מהסביבה החיצונית (אש), בעוד שהוא עצמו מקרין אנרגיה בצורת חום, וגם מים מתאדים ממנו (מטבוליזם)
- סגור. במערכות כאלה אין חילופי חומר עם הסביבה, למרות שמתרחש חילופי אנרגיה. נחזור למקרה הקודם: אם מכסים את הקומקום במכסה, ניתן לקבל מערכת סגורה.
- מבודד. מדובר במעין מערכות תרמודינמיות שאינן מחליפות חומר או אנרגיה עם המרחב שמסביב. דוגמה תהיה תרמוס המכיל תה חם.
טמפרטורה תרמודינמית

מושג זה פירושו האנרגיה הקינטית של החלקיקים היוצרים את הגופים שמסביב, המשקפת את המהירותתנועה אקראית של חלקיקים. ככל שהוא גדול יותר, כך הטמפרטורה גבוהה יותר. בהתאם לכך, על ידי הפחתת האנרגיה הקינטית של המערכת, אנו מצננים אותה.
מושג זה פירושו האנרגיה הקינטית של החלקיקים היוצרים את הגופים שמסביב, המשקפת את מהירות התנועה הכאוטית של חלקיקים. ככל שהוא גדול יותר, כך הטמפרטורה גבוהה יותר. בהתאם לכך, על ידי הפחתת האנרגיה הקינטית של המערכת, אנו מצננים אותה.
הטמפרטורה התרמודינמית מתבטאת ב-SI (מערכת היחידות הבינלאומית) בקלווין (לכבודו של המדען הבריטי וויליאם קלווין, שהציע לראשונה סולם זה). הבנת החוקים הראשון, השני והשלישי של התרמודינמיקה בלתי אפשרית ללא הגדרה של טמפרטורה.
חלוקה של מעלה אחת בסולם קלווין מתאימה גם למעלה אחת צלזיוס. ההמרה בין יחידות אלו מתבצעת לפי הנוסחה: TK =TC + 273, 15, כאשר TK ו-TC - טמפרטורות בקלווין ובמעלות צלזיוס בהתאמה.
המוזרות של סולם קלווין היא שאין לו ערכים שליליים. אפס בו (TC=-273, 15 oC) מתאים למצב שבו התנועה התרמית של חלקיקי המערכת נעדרת לחלוטין, נראה שהם "מוקפאים".
שימור האנרגיה והחוק הראשון של התרמודינמיקה

בשנת 1824, ניקולא לאונרד סאדי קרנו, מהנדס ופיזיקאי צרפתי, הציע הצעה נועזת שלא רק הובילה לפיתוח הפיזיקה, אלא גם הפכה לצעד מרכזי בשיפור הטכנולוגיה. שֶׁלוֹניתן לנסח כך: "לא ניתן ליצור או להרוס אנרגיה, ניתן להעביר אותה רק ממדינה אחת לאחרת."
למעשה, הביטוי של סאדי קרנו מניח את חוק שימור האנרגיה, אשר היווה את הבסיס לחוק הראשון של התרמודינמיקה: "בכל פעם שמערכת מקבלת אנרגיה מבחוץ, היא ממירה אותה לצורות אחרות, העיקריות של שהם תרמיים ומכאניים."
הנוסחה המתמטית של החוק הראשון כתובה כך:
Q=ΔU + A, כאן Q היא כמות החום שמועברת על ידי הסביבה למערכת, ΔU היא השינוי באנרגיה הפנימית של מערכת זו, A היא העבודה המכנית המושלמת.
תהליכים אדיאבטיים
דוגמה טובה להם היא תנועת המוני אוויר לאורך מדרונות ההרים. מסות כאלה הן ענקיות (קילומטרים או יותר), והאוויר הוא מבודד חום מצוין. המאפיינים המצוינים מאפשרים לנו להתייחס לכל תהליכים עם מסות אוויר המתרחשות תוך זמן קצר כאדיאבטיות. כאשר האוויר עולה במדרון ההר, הלחץ שלו יורד, הוא מתרחב, כלומר הוא מבצע עבודה מכנית, וכתוצאה מכך הוא מתקרר. להיפך, תנועת מסת האוויר כלפי מטה מלווה בעלייה בלחץ בה, היא נדחסת ובשל כך מתחממת מאוד.
היישום של חוק התרמודינמיקה, שנדון בכותרת המשנה הקודמת, מודגם בצורה הקלה ביותר באמצעות הדוגמה של תהליך אדיאבטי.
לפי ההגדרה, כתוצאה מכך אין חילופי אנרגיה עםסביבה, כלומר במשוואה למעלה, Q=0. זה מוביל לביטוי הבא: ΔU=-A. סימן המינוס כאן אומר שהמערכת מבצעת עבודה מכנית על ידי הפחתת האנרגיה הפנימית שלה. יש לזכור שהאנרגיה הפנימית תלויה ישירות בטמפרטורת המערכת.
כיוון של תהליכים תרמיים
גיליון זה עוסק בחוק השני של התרמודינמיקה. ודאי כולם שמו לב שאם אתה מביא שני חפצים עם טמפרטורות שונות במגע, אז הקר תמיד יתחמם, והחם יתקרר. שימו לב שהתהליך ההפוך יכול להתרחש במסגרת החוק הראשון של התרמודינמיקה, אך הוא לעולם לא מיושם בפועל.
הסיבה לבלתי הפיך של תהליך זה (וכל התהליכים הידועים ביקום) היא המעבר של המערכת למצב סביר יותר. בדוגמה הנחשבת עם מגע של שני גופים בטמפרטורות שונות, המצב הסביר ביותר יהיה זה שבו לכל חלקיקי המערכת תהיה אותה אנרגיה קינטית.
ניתן לנסח את החוק השני של התרמודינמיקה כך: "לעולם לא ניתן להעביר חום באופן ספונטני מגוף קר לגוף חם." אם נציג את המושג אנטרופיה כמדד לאי-סדר, אזי ניתן לייצג אותו באופן הבא: "כל תהליך תרמודינמי ממשיך עם עלייה באנטרופיה".
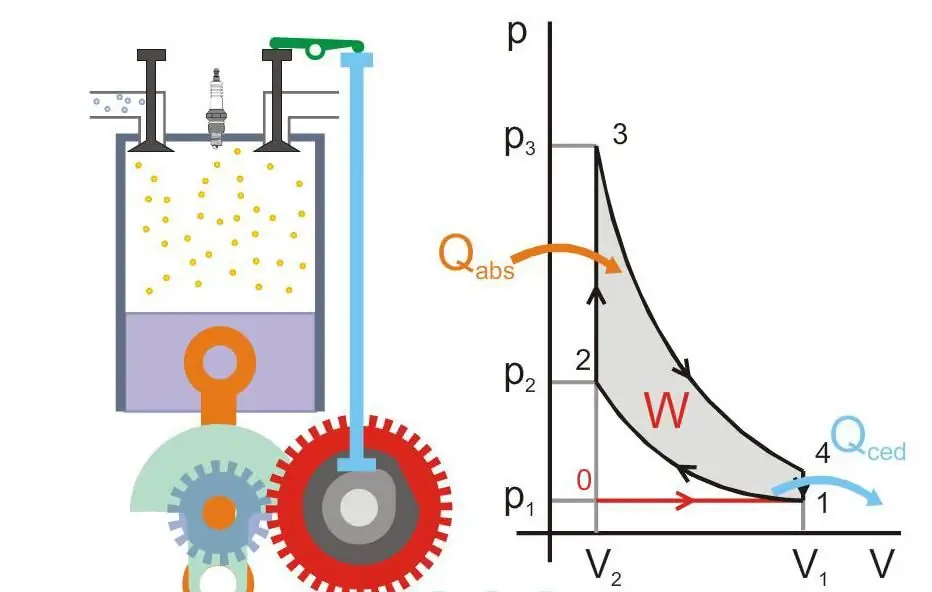
מנוע חום

מושג זה מובן כמערכת שבגלל אספקת אנרגיה חיצונית אליה, יכולה לבצע עבודה מכנית. ראשוןמנועי חום היו מנועי קיטור והומצאו בסוף המאה ה-17.
החוק השני של התרמודינמיקה ממלא תפקיד מכריע בקביעת יעילותם. סאדי קרנו גם קבע שהיעילות המקסימלית של מכשיר זה היא: יעילות=(T2 - T1)/T2, כאן T2 ו-T1 הן טמפרטורות של תנור ומקרר. עבודה מכנית יכולה להיעשות רק כאשר יש זרימת חום מגוף חם לגוף קר, ולא ניתן להמיר זרימה זו ב-100% לאנרגיה שימושית.
האיור שלהלן מציג את עקרון הפעולה של מנוע חום (Qabs - חום מועבר למכונה, Qced - איבוד חום, W - עבודה שימושית, P ו-V - לחץ ונפח גז בבוכנה).
אפס מוחלט וההנחה של נרנסט
לבסוף, בואו נעבור לשיקול של החוק השלישי של התרמודינמיקה. היא נקראת גם הנחת נרנסט (שמו של הפיזיקאי הגרמני שניסח אותה לראשונה בתחילת המאה ה-20). החוק אומר: "לא ניתן להגיע לאפס מוחלט עם מספר סופי של תהליכים". כלומר, אי אפשר בשום אופן "להקפיא" לחלוטין את המולקולות והאטומים של חומר. הסיבה לכך היא חילופי החום הקבועים הקיימים עם הסביבה.

מסקנה שימושית אחת שנגזרת מהחוק השלישי של התרמודינמיקה היא שהאנטרופיה יורדת ככל שמתקדם לעבר האפס המוחלט. המשמעות היא שהמערכת נוטה לארגן את עצמה. עובדה זו יכולההשתמש, למשל, כדי להעביר פרמגנטים למצב פרומגנטי בעת קירור.
מעניין לציין שהטמפרטורה הנמוכה ביותר שהושגה עד כה היא 5·10−10 K (2003, MIT laboratory, ארה ב).






