שיטת הניתוח המוליכה היא מדידת מוליכות אלקטרוליטית כדי לפקח על התקדמות תגובה כימית. מדע זה מיושם באופן נרחב בכימיה אנליטית, כאשר טיטרציה היא שיטת פעולה סטנדרטית. מהי מוליכותמטריה? בתרגול נפוץ בכימיה אנליטית, המונח משמש כמילה נרדפת לטיטרציה, בעוד שהוא משמש גם לתיאור יישומים ללא טיטרציה. מה היתרון בשימוש בשיטת ניתוח זו? הוא משמש לעתים קרובות כדי לקבוע את המוליכות הכוללת של תמיסה או לנתח את נקודת הסיום של טיטרציה הכוללת יונים.
היסטוריה
מדידות מוליכות החלו כבר במאה ה-18, כאשר אנדריאס באומגרטנר הבחין שהמים המלח והמינרליים מבאד גשטיין באוסטריה מוליכה חשמל. לפיכך, השימוש בשיטה זו לקביעת טוהר המים, המשמשת כיום לרוב לבדיקת יעילותן של מערכות טיהור מים, החל בשנת 1776. כך החלה ההיסטוריה של שיטת הניתוח הקונדוקטומטרית.
פרידריך קולראוש המשיך בפיתוח המדע הזה בשנות ה-60, כאשר הפעיל זרם חילופין על מים, חומצות ותמיסות אחרות. בערך בזמן הזה, וויליס ויטני, שחקר את האינטראקציות של חומצה גופרתית ומתחמי כרום גופרתי, מצא את נקודת הסיום הראשונה. ממצאים אלו הגיעו לשיאם בטיטרציה פוטנציומטרית והמכשיר הראשון לניתוח נפחי על ידי רוברט בהרנד בשנת 1883 בטיטרציה של כלוריד וברומיד HgNO3. לפיכך, שיטת האנליזה המודרנית המוליך מבוססת על Behrend.
פיתוח זה אפשר לבחון את מסיסות המלחים ואת ריכוז יוני המימן, וכן טיטרציות חומצה-בסיס וחיזור. שיטת הניתוח הקונדוקטומטרית שופרה עם פיתוח אלקטרודת הזכוכית, שהחלה ב-1909.
Titration
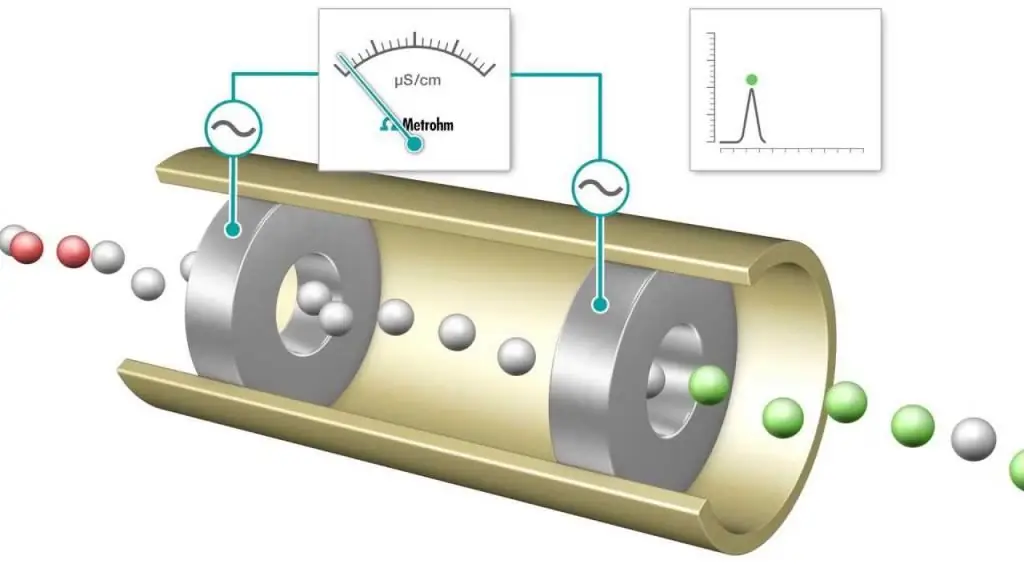
טיטרציה מוליכות היא מדידה שבה מוליכות האלקטרוליטית של תערובת תגובה מנוטרת ברציפות על ידי הוספת מגיב אחד. נקודת השקילות היא הנקודה שבה המוליכות משתנה לפתע. עלייה או ירידה ניכרת במוליכות קשורה לשינוי בריכוז של שני היונים המוליכים ביותר, יוני מימן והידרוקסיד. השיטה הזאתיכול לשמש לטיטרציה של תמיסות צבעוניות או תרחיפים הומוגניים (למשל תרחיף עיסת עץ) שלא ניתן להשתמש בהם עם אינדיקטורים קונבנציונליים.
טיטרציות חומצה-בסיס וחיזור מבוצעות לעתים קרובות, המשתמשות באינדיקטורים נפוצים לקביעת נקודת הסיום, כגון מתיל כתום, פנולפתלין לטיטרציה של חומצה-בסיס ותמיסות עמילן לתהליך חיזור מסוג יודומטרי. עם זאת, מדידות מוליכות חשמלית יכולות לשמש גם ככלי לקביעת נקודת הקצה, למשל בעת צפייה בתמיסה של HCl עם הבסיס החזק NaOH.
נטרול פרוטונים
ככל שהטיטרציה מתקדמת, פרוטונים מנוטרלים ליצירת NaOH על ידי יצירת מים. עבור כל כמות של NaOH שנוספת, מסירים מספר שווה של יוני מימן. למעשה, קטיון H+ הנייד מוחלף ביון Na+ הנייד פחות, והמוליכות של התמיסה הטיטררית, כמו גם מוליכות התא הנמדדת, יורדת. זה נמשך עד שמגיעים לנקודת שוויון שבה ניתן להשיג תמיסה של נתרן כלורי NaCl. אם מוסיפים עוד בסיס, יש עלייה ככל שמוסיפים יותר יוני Na+ ו-OH- ותגובת הנטרול כבר לא מסירה כמות ניכרת של H+.

כתוצאה מכך, כאשר חומצה חזקה עוברת טיטרציה עם בסיס חזק, למוליכות יש מינימום בנקודת השקילות. המינימום הזהניתן להשתמש במקום צבע אינדיקטור כדי לקבוע את נקודת הסיום של טיטרציה. עקומת הטיטרציה היא גרף של ערכים נמדדים של מוליכות או מוליכות כפונקציה של נפח תמיסת ה-NaOH הנוספת. ניתן להשתמש בעקומת הטיטרציה כדי לקבוע באופן גרפי את נקודת השקילות. שיטת הניתוח (והשימוש בה) רלוונטית ביותר בכימיה מודרנית.
Reaction
עבור תגובה בין בסיס חלש חומצה-חלש, המוליכות החשמלית יורדת תחילה במידת מה, מכיוון שמשתמשים במעט יוני H+ זמינים. ואז המוליכות עולה מעט עד לנפח של נקודת השקילות עקב תרומת קטיון המלח והאניון (תרומה זו במקרה של בסיס חומצי חזק זניחה ואינה נחשבת שם) לאחר הגעה לנקודת השקילות., המוליכות עולה במהירות עקב עודף של יוני OH.
גלאי מוליכות (שיטת ניתוח מוליכות) משמשים גם למדידת ריכוזי אלקטרוליטים בתמיסות מימיות. ניתן לקבל את הריכוז המולארי של האנליט שיוצר את מוליכות התמיסה מההתנגדות החשמלית הנמדדת של התמיסה.
שיטת ניתוח מוליכים: עקרון ונוסחאות
(2.4.13) C=Constcell1Λm1Res, כאשר Constcell הוא ערך קבוע בהתאם לתא המדידה, Res היא ההתנגדות החשמלית הנמדדת על ידי המכשיר (לפי חוק אוהם Res=I / V, ועם קבוע מדידת מתח V, עוצמת I מאפשרת לך לחשב Res), ו-Λm היא המקבילהמוליכות עבור חלקיקים יוניים. למרות שלמטרות מעשיות Λm יכול להיחשב קבוע, זה תלוי בריכוז לפי חוק קולראוש:
(2.4.14)=Хт Λm0-ΘC, כאשר Θ הוא קבוע, ו-Λm0 הוא המוליכות המולרית המגבילה האופיינית לכל יון. מוליכות מולרית, בתורה, תלויה בטמפרטורה.
Scrit
פיתוח השיטה הקונדוקטומטרית לניתוח מדידה הובילה מדענים לתגליות חדשות. המדענים קבעו את יחס רווית-העל הקריטי, Scrit, באמצעות הולכה במערכת משקעים של AgCl הומוגנית בתוספת של יוני Ag+, תוך שימוש בהידרוליזה של אלקיל כלוריד כמקור ליוני CI. הם מצאו Scrit=1.51, 1.73 ו-1.85 ב-15, 25 ו-35°C בהתאמה, כאשר S=([Ag+][Cl-] / Ksp) 1/2 לפי ההגדרה שלהם. אם הגדרה זו של גורם רווית העל מומרת לשלנו (S=[Ag+][Cl-] / Ksp), התוצאות הן 2.28, 2.99 ו-3.42, בהתאמה, בהתאמה טובה למדי לתוצאות המחקר הנוכחי. עם זאת, תלות הטמפרטורה של Scrit הפוכה לזו המתוארת במחקר הנוכחי. למרות שהסיבה לסתירה זו אינה ברורה, הירידה ב- Scrit עם עליית הטמפרטורה עשויה להיות סבירה למדי, שכן קצב הגרעין משתנה באופן דרמטי עם שינוי קטן ב- ΔGm/ kT, ולכן ΔGm/ kT, שהוא פרופורציונלי ל- T − 3 (lnSm) 2 לפי הנוסחה (1.4.12) נחשב כמעט קבוע עם שינוי הטמפרטורה במערכת הנתונה. אגב, ההגדרה של S חייבת להיות [Ag +] [Cl -] / Ksp, שכן יחס רווית העל במונחים שלריכוז המונומר [AgCl] ניתן בתחילה כ-S=[AgCl] / [AgCl] (∞)=[Ag +] [Cl -] / Ksp.
טנקה ואיוואסקי
ההיסטוריה של שיטת הניתוח הקונדוקטומטרית נמשכה על ידי שני מדענים יפנים איקוניים. טנאקה ואיוואסאקי חקרו את תהליך יצירת הגרעינים של חלקיקי AgCl ו-AgBr בשיטת זרימה עוצרת בשילוב עם ספקטרופוטומטר רב-ערוצי, שימושי לחקר תהליך מהיר בסדר גודל של msec. הם מצאו כי איזשהו קומפלקס הליד כסף ספציפי AgXm (m-1), בעל פס ספיגת UV צר למדי, נוצר באופן מיידי כאשר ערבבו תמיסה של AgC104 בסדר גודל של 10-4 מול dm-3 עם KX (X=תמיסה של Cl או Br) בסדר גודל של מ-10-2 עד 10-1 מול dm-3 ואחריה דעיכה מהירה של כ-10 ms עם היווצרות של תוצר ביניים בעל ספיגת UV רחבה ושינוי איטי בהרבה בספקטרום של מוצר הביניים. הם פירשו את התווך כליבות מונו-פזרות (AgX) n המורכבות מ-n מולקולות וקבעו את n מהיחס הנראה -dC/dt α Cn ב-t=0 עבור ריכוזים ראשוניים שונים של C precursor AgXm (m-1) - (n=7 -10 עבור AgCl, n=3-4 עבור AgBr).

עם זאת, מכיוון שהמבשר AgXm (m − 1) מתפורר באופן לא נייח, התיאוריה של גרעין מעין-ניחוני אינה חלה בתהליך זה, ולפיכך הערך המתקבל של n אינו מתאים ל- nערך של גרעינים קריטיים. אם תוצר הביניים מכיל גרעינים חד מפוזרים,נוצר על ידי הקומפלקס המונומרי, ייתכן שהיחס -dC/dt α C לא יישמר. אלא אם נניח שצבירים קטנים מ-n-mers נמצאים בשיווי משקל, ki − 1, ici − 1c1=ki, i − 1ci, זה עם זה בתגובה רציפה c1 → c2 → c3 →… → cn − 1 → cn., ורק הצעד האחרון cn − 1 → cn הוא בלתי הפיך; כלומר c1⇌c2⇌c3⇌… ⇌cn − 1 → cn.
חוץ מזה, יש להניח שלריכוזי אשכולות מ-2 עד n-1 יש ריכוזי שיווי משקל זניחים. עם זאת, נראה שאין בסיס להצדיק הנחות אלו. מצד שני, ניסינו לחשב את הרדיוסים של גרעינים קריטיים ואת מקדמי רווית העל S בסוף התהליך המהיר, תוך שימוש ב- γ=101 mJ m − 2 עבור AgCl19 מעוקב ו- γ=109 mJ m − 2 עבור AgBr20 מעוקב, בהנחה שהערכים של n, 7-10 עבור AgCl19 ו-3-4 עבור AgBr20, שווים לגודלם של גרעינים חד מפוזרים, n. שיטת הניתוח הקונדוקטומטרית, שסקירותיה נעות בין אישור פשוט להתפעלות, הולידה מחדש את הכימיה כמדע.
כתוצאה מכך, מדענים גילו את הנוסחה הבאה: r=0.451 ננומטר ו-S=105 עבור AgCl עם n=9; r=0.358 ננומטר ו-S=1230 עבור AgBr עם n=4. מכיוון שהמערכות שלהם דומות לאלו של דייוויס וג'ונס, שהשיגו רוויה-על קריטית של AgCl של בערך 1.7-2.0 ב-25 מעלות צלזיוס. באמצעות מוליכות תערובת ישירה בנפחים שווים של תמיסות מימיות מדוללות של AgNO3 ו-KCl, ערכי S גבוהים במיוחד עשויים שלא לשקף גורמי רוויה-על בפועל.בשיווי משקל עם גרעיני ביניים.
ספיגת UV
נראה הגיוני יותר לייחס תוצר ביניים עם ספיגת UV רחבה לגרעינים גדולים בהרבה מהממוצע עם התפלגות גודל רחבה שנוצרת על ידי תגובה רציפה לא נייחת. נראה שהשינוי האיטי של גרעיני הביניים שלאחר מכן קשור להתבגרותם באוסטוולד.

בהקשר לעיל, הכימאי האמריקאי נילסן גם הסיק nדומה בסביבות 12 ו-S מקביל גדול מ-103 עבור גרעין של חלקיקי בריום גופרתי ממדידות עכירות כפונקציה של רוויה-על, באמצעות n=dlogJ / dlogC בתיאוריה דמוית בכר-דרינג לנוסחה. (1.3.37), אבל נתינה (n+ 1) במקום n. מכיוון שתמיסות של יוני בריום ויוני סולפט עורבבו ישירות בניסוי זה, גרעין חולף מהיר היה צריך להסתיים מיד לאחר הערבוב, ומה שנמדד יכול להיות קצב ההתבגרות האיטית של אוסטוולד ו/או ההיתוך של הגרעינים שנוצרו. ככל הנראה, זו הסיבה לערך הקטן באופן בלתי סביר של n ולרוויה העל הגבוהה ביותר. לכן, עלינו שוב לציין שמאגר כלשהו של מינים מונומריים המשחרר אותם בתגובה לצריכתם נחוץ תמיד כדי להשיג גרעין מעין-נייח במערכת סגורה. כל התיאוריות הקלאסיות של גרעין, כולל תיאוריית בכר-דורינג, מניחות באופן מרומז מצב כזה. הגדרה של מוליךשיטת הניתוח ניתנה בחלקי המאמר למעלה.
מדענים אחרים חקרו את התהליך של גרעין חולף של הליד כסף על ידי רדיוליזה פעימה של מים המכילים מתילן הליד ויוני כסף, במהלכו מתפרק המתילן הליד לשחרור יוני הליד על ידי אלקטרונים hydrated הנוצרים על ידי קרינה פועמת בטווח מ-4 ns עד 3 מיקרון. הספקטרום של המוצרים תועד באמצעות מכפיל פוטו ומצלמת פסים ומבשרי הליד כסף מונומריים נמצאו שנוצרו לאורך זמן בסדר גודל של מיקרו-שניות ולאחר מכן תהליך גרעין דומה לזה שנצפה על ידי טנקה ואיוואסאקי. התוצאות שלהם מראות בבירור שתהליך יצירת גרעין של הלודי כסף על ידי ערבוב ישיר של המגיבים מורכב משני שלבים יסודיים; כלומר, היווצרות מבשר מונומרי בסדר גודל של μs והמעבר לאחר מכן לגרעין בסדר גודל של 10 ms. יש לציין שהגודל הממוצע של גרעינים הוא כ-10 ננומטר.
רוויה
לגבי מקדמי רוויה-על ליצירת גרעין של חלקיקי AgCl במערכות פתוחות שבהן ריכוזים גבוהים של מגיבים כמו AgNO3 ו-KCl מוכנסים ברציפות לתמיסת הג'לטין לאורך המשקעים, Strong ו-Wey31 דיווחו על 1.029 (80°C) - 1.260 (40 מעלות צלזיוס) ו-Leubner32 דיווחו על 1.024 ב-60 מעלות צלזיוס כפי שהוערך מדידת קצב הגדילה של חלקיקי זרעי AgCl ברוויית-על קריטית. זוהי המהות של שיטת הקונדוקטומטרית של ניתוח כמותי.
מצד שני, עבור מערכות חלקיקי AgBr פתוחות, חלקןערכים משוערים של מקדם רווית העל הקריטי, Scrit: Scrit∼-1.5 ב-70 מעלות צלזיוס לפי Wey ו-Strong33 מקצב הגדילה המקסימלי תלוי הגודל שנקבע על ידי מציאת סף הריבוי מחדש בקצבים שונים של הוספת תמיסת AgNO3 ל-KBr תמיסה בנוכחות חלקיקי זרעים על ידי הסילונים הכפולים; Scrit=1.2-1.5 ב-25 מעלות צלזיוס לפי Jagannathan ו-Wey34 כגורם רווית העל המקסימלי שנקבע ממשוואת גיבס-תומסון עם הנתונים שלהם על הגודל הממוצע המינימלי של גרעינים שנצפה במיקרוסקופיה אלקטרונית במהלך שלב הגרעין של משקעים AgBr דו-סילוני. זה יעיל מאוד כאשר מיישמים את שיטת הכימות המולינקית.

בעת חישוב ערכי Scrit אלה, הם לקחו γ=140 mJ m − 2. מכיוון שגרעין במערכות פתוחות מתאים לתהליך ההישרדות של גרעינים בהתהוות שנוצרו באזור מקומי של רווית-על גבוהה במיוחד ליד יציאות המגיבים, קריטי רוויה-על מתאימה לריכוז המומס בשיווי משקל עם גרעינים בגודל מקסימלי, אם נשתמש בנתונים של Sugimoto35 על הרדיוס המרבי של גרעיני AgBr במערכות פתוחות (.3 8.3 ננומטר) עם γ תיאורטי עבור AgBr מעוקב (=109 mJ m − 2) 3, אז גורם רווית העל הקריטי, Scrit, מחושב כך שיהיה 1.36 ב-25°C (אם מניחים ש- γ הוא 140 mJ/m2, אז Scrit=1.48).
כתוצאה מכך, בכל מקרה, רווי-על קריטיים במערכות פתוחות של חלקיקי הליד כסף נמצאות בדרך כלל הרבה מתחת לרוויות העל המקסימליות (כנראה קרובות לרוויות-על קריטיות) במערכות סגורות. הסיבה לכך היא שהרדיוס הממוצע של גרעינים שנוצר באזור המקומי של מערכת פתוחה גדול בהרבה מ-rm במערכת סגורה, כנראה בגלל היתוך מיידי של גרעינים ראשוניים מרוכזים מאוד באזור המקומי של מערכת פתוחה עם רמה גבוהה ריכוז אלקטרוליטים מקומי.
Application
השימוש בשיטת הטיטרציה הקונדומטרית לרישום רציף במהלך תהליכים אנזימטיים נחקר ונותח רבות. כמעט כל השיטות האנליטיות האלקטרוכימיות מבוססות על תגובות אלקטרוכימיות (פוטנציומטריה, וולטמטריה, אמפרומטריה, קולומטריה).
שיטת הניתוח הקונדומטרית היא שיטה שבה או שאין תגובות אלקטרוכימיות על האלקטרודות כלל, או שישנן תגובות משניות שניתן להזניח. לכן, בשיטה זו, התכונה החשובה ביותר של תמיסת האלקטרוליט בשכבת הגבול היא המוליכות החשמלית שלה, המשתנה בהתאם למגוון רחב למדי של תגובות ביולוגיות.
הטבות
לחיישנים ביולוגיים מוליכים יש גם כמה יתרונות על פני סוגים אחרים של מתמרים. ראשית, ניתן ליצור אותם באמצעות טכנולוגיה סטנדרטית של סרט דק בעלות נמוכה. זה, יחד עם השימוש בשיטה אופטימלית לשיקום חומר ביולוגי, מוביל להפחתה משמעותית הן בעלות העיקרית של המכשירים והןהעלות הכוללת של הניתוח. עבור חיישני מיקרוביו מובנים, קל לבצע מצב מדידה דיפרנציאלי, המפצה על השפעות חיצוניות ומשפר מאוד את דיוק המדידה.
הנתונים מראים בבירור את הפוטנציאל הגדול של חיישנים ביולוגיים מוליכים. עם זאת, זו עדיין מגמה חדשה למדי בחיישנים ביולוגיים, כך שלפיתוח מכשירים מסחריים יש עתיד מבטיח.
שיטות חדשות
כמה מדענים תיארו שיטה כללית למדידת pKa על ידי מוליכות. שיטה זו הייתה בשימוש נרחב עד 1932 בערך (לפני שנעשה שימוש בשיטות מדידת pH). השיטה הקונדומטרית רגישה ביותר לטמפרטורה ולא ניתן להשתמש בה למדידת ערכי pKa חופפים. יתרון אפשרי לדגימות ללא כרומופור הוא שניתן להשתמש בו בתמיסות מדוללות מאוד, עד 2.8 × 10-5 M. בשנים האחרונות נעשה שימוש בקונדוקמטריה 87 למדידת ה-pKa של לידוקאין, למרות שהתוצאה שהתקבלה הייתה 0.7 ליחידה מתחת לערך ה-pH המקובל.

אלברט וסרג'נט תיארו גם שיטה לקביעת pKa ממדידות מסיסות. כפי שהוזכר לעיל, המסיסות תלויה ב-pKa, כך שאם המסיסות נמדדת בערכי pH מרובים על עקומה, ניתן לקבוע את ה-pKa. פק ובנט תיארו שיטה כללית להערכת ערכי pKa עבור חומרים מונופרוטיים, דיפרוטיים ואמפוטריים בהינתן סט של מדידות מסיסות ו-pH. הנסן והפליגר השיגו את ה-pKa של המדגם, אשרמתפרק במהירות על ידי הידרוליזה משיעורי הפירוק הראשוניים שלו כפונקציה של ה-pH בהתקן דיסק מסתובב. התוצאה תואמת היטב את תוצאת ה-pH/UV, אך הפירוק מקשה על השיטה האחרונה. זהו, בגדול, תיאור של שיטת הניתוח הקונדומטרית.






