תיאוריה מולקולרית-קינטית מאפשרת, על ידי ניתוח ההתנהגות המיקרוסקופית של המערכת ושימוש בשיטות של מכניקה סטטיסטית, להשיג מאפיינים מקרוסקופיים חשובים של המערכת התרמודינמית. אחד המאפיינים המיקרוסקופיים, הקשור לטמפרטורת המערכת, הוא המהירות המרובעת הממוצעת של מולקולות הגז. אנו נותנים את הנוסחה עבורו ושוקלים אותה במאמר.
גז אידיאלי
אנו מציינים מיד שהנוסחה למהירות הממוצעת הריבועית של מולקולות גז תינתן במיוחד עבור גז אידיאלי. במסגרתו, בפיזיקה, נחשבת מערכת מרובת-חלקיקים כזו שבה חלקיקים (אטומים, מולקולות) אינם מקיימים אינטראקציה זה עם זה (האנרגיה הקינטית שלהם עולה על האנרגיה הפוטנציאלית של אינטראקציה במספר סדרי גודל) ואין להם ממדים, כלומר, הן נקודות בעלות מסה סופית (המרחק בין חלקיקים הגדול בכמה סדרי גודל מגודלם.ליניארי).
כל גז המורכב ממולקולות או אטומים ניטרליים מבחינה כימית, ושנמצא בלחץ נמוך ובעל טמפרטורה גבוהה, יכול להיחשב אידיאלי. לדוגמה, אוויר הוא גז אידיאלי, אבל אדי מים כבר אינם כאלה (קשרי מימן חזקים פועלים בין מולקולות מים).
תיאוריה קינטית מולקולרית (MKT)

למידת גז אידיאלי במסגרת ה-MKT, כדאי לשים לב לשני תהליכים חשובים:
- גז יוצר לחץ על ידי העברה לדפנות הכלי שמכיל אותו, את המומנטום שבו מולקולות ואטומים מתנגשים בהם. התנגשויות כאלה הן אלסטיות לחלוטין.
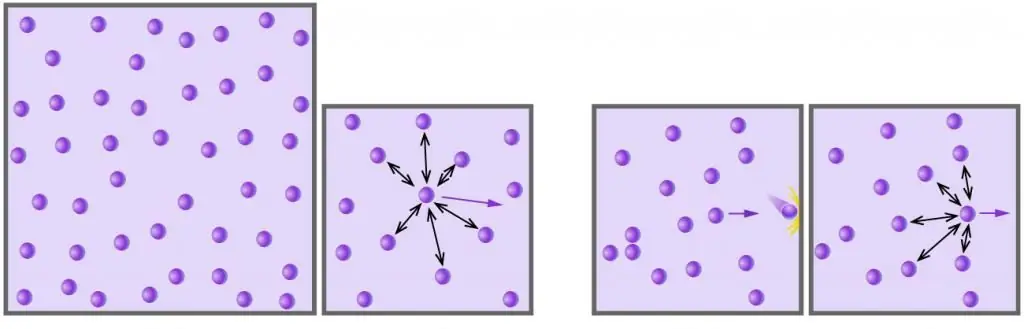
- מולקולות ואטומי גז נעים באקראי לכל הכיוונים במהירויות שונות, שהתפלגותם מצייתת לסטטיסטיקה של מקסוול-בולצמן. ההסתברות להתנגשות בין חלקיקים נמוכה ביותר, בשל גודלם הזניח והמרחקים הגדולים ביניהם.
למרות העובדה שהמהירויות הבודדות של חלקיקי הגז שונות מאוד זו מזו, הערך הממוצע של ערך זה נשאר קבוע לאורך זמן אם אין השפעות חיצוניות על המערכת. ניתן לקבל את הנוסחה למהירות הריבועית הממוצעת של מולקולות גז על ידי התחשבות בקשר בין אנרגיה קינטית לטמפרטורה. נעסוק בנושא זה בפסקה הבאה של המאמר.
גזירת הנוסחה למהירות הממוצעת הריבועית של מולקולות גז אידיאליות
כל תלמיד יודע מהקורס הכללי של הפיזיקה שהאנרגיה הקינטית של תנועת התרגום של גוף בעל מסה m מחושבת באופן הבא:
Ek=mv2/2
כאשר v היא המהירות הליניארית. מצד שני, ניתן לקבוע את האנרגיה הקינטית של חלקיק גם במונחים של הטמפרטורה המוחלטת T, באמצעות מקדם ההמרה kB(קבוע בולצמן). מכיוון שהמרחב שלנו הוא תלת מימדי, Ek מחושב באופן הבא:
Ek=3/2kBT.
מקביל לשני השוויון ומבטאת v מהם, אנו מקבלים את הנוסחה למהירות הממוצעת של גז אידיאלי ריבועי:
mv2/2=3/2kBT=>
v=√(3kBT/m).
בנוסחה זו, m - היא המסה של חלקיק הגז. הערך שלו לא נוח לשימוש בחישובים מעשיים, מכיוון שהוא קטן (≈ 10-27kg). כדי למנוע אי נוחות זו, הבה נזכיר את קבוע הגז האוניברסלי R ואת המסה המולרית M. הקבוע R עם kB קשור בשוויון:
kB=R/NA.
הערך של M מוגדר באופן הבא:
M=mNA.
בהתחשב בשני השוויון, נקבל את הביטוי הבא למהירות השורש-ממוצע-ריבוע של מולקולות:
v=√(3RT/M).
לפיכך, המהירות הריבועית הממוצעת של חלקיקי הגז עומדת ביחס ישר לשורש הריבועי של הטמפרטורה המוחלטת וביחס הפוך לשורש הריבועי של המסה המולרית.
דוגמה לפתרון בעיות
כולם יודעים שהאוויר שאנו נושמים הוא 99% חנקן וחמצן. יש צורך לקבוע את ההבדלים במהירויות הממוצעות של המולקולות N2 ו-O2 בטמפרטורה של 15 o C.

בעיה זו תיפתר ברצף. ראשית, אנו מתרגמים את הטמפרטורה ליחידות מוחלטות, יש לנו:
T=273, 15 + 15=288, 15 K.
כעת כתוב את המסות הטוחנות עבור כל מולקולה הנבדקת:
MN2=0.028 ק ג/מול;
MO2=0.032 ק ג/מול.
מכיוון שהערכים של המסות הטוחנות שונות במקצת, גם המהירויות הממוצעות שלהן באותה טמפרטורה צריכות להיות קרובות. באמצעות הנוסחה של v, נקבל את הערכים הבאים עבור מולקולות חנקן וחמצן:
v (N2)=√(38, 314288, 15/0, 028)=506.6 m/s;
v (O2)=√(38, 314288, 15/0, 032)=473.9 m/s.
מכיוון שמולקולות חנקן מעט קלות יותר ממולקולות חמצן, הן נעות מהר יותר. הפרש המהירות הממוצע הוא:
v (N2) - v (O2)=506.6 - 473.9=32.7 m/s.
הערך המתקבל הוא רק 6.5% מהמהירות הממוצעת של מולקולות חנקן. אנו מפנים את תשומת הלב למהירויות הגבוהות של מולקולות בגזים, אפילו בטמפרטורות נמוכות.






