קיבולת החום של גז היא כמות האנרגיה שגוף סופג כשהוא מחומם במעלה אחת. בואו ננתח את המאפיינים העיקריים של כמות פיזית זו.

הגדרות
החום הסגולי של גז הוא יחידת המסה של חומר מסוים. יחידות המידה שלו הן J/(kg·K). כמות החום שנספגת בגוף בתהליך של שינוי מצב הצבירה שלו קשורה לא רק למצב ההתחלתי והסופי, אלא גם לשיטת המעבר.

Department
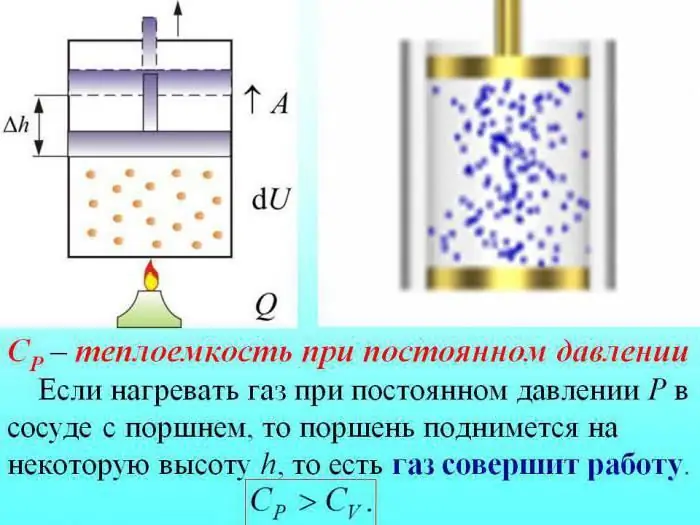
קיבולת החום של גזים מחולקת בערך שנקבע בנפח קבוע (Cv), לחץ קבוע (Cр).
במקרה של חימום ללא שינוי הלחץ, קצת חום מושקע כדי לייצר את עבודת הרחבת הגז, וחלק מהאנרגיה מושקעת להגברת האנרגיה הפנימית.
קיבולת החום של גזים בלחץ קבוע נקבעת לפי כמות החום המושקעת בהגדלת האנרגיה הפנימית.
מצב גז: תכונות, תיאור
קיבולת החום של גז אידיאלי נקבעת תוך התחשבות בעובדה ש- Сp-Сv=R. הכמות האחרונה נקראת קבוע הגז האוניברסלי. הערך שלו מתאים ל-8.314 J/(מול K).
כאשר מבצעים חישובים תיאורטיים של קיבולת חום, למשל, מתארים את הקשר עם הטמפרטורה, לא מספיק להשתמש רק בשיטות תרמודינמיות, חשוב להתחמש באלמנטים של פיזיקה סטטית.
קיבולת החום של גזים כוללת חישוב של הערך הממוצע של האנרגיה של תנועת התרגום של כמה מולקולות. תנועה כזו מסוכמת מהתנועה הסיבובית והטרנסלציונית של המולקולה, כמו גם מהתנודות הפנימיות של אטומים.
בפיזיקה הסטטית, יש מידע שלפיו לכל דרגת חופש של תנועה סיבובית ותנועה, ישנה כמות לגז ששווה למחצית מקובוע הגז האוניברסלי.

עובדות מעניינות
לחלקיק של גז מונוטומי מניחים שיש שלוש דרגות חופש תרגום, כך שלחום הספציפי של גז יש שלוש דרגות חופש תרגום, שתי סיבוביות ואחת תנודתית. חוק הפיזור האחיד שלהם מוביל להשוואת החום הסגולי בנפח קבוע ל-R.
במהלך הניסויים, נמצא כי קיבולת החום של גז דו-אטומי תואמת את הערך R. אי התאמה כזו בין תיאוריה לפרקטיקה מוסברת בכך שכושר החום של גז אידיאלי קשור לקוונטי לכן, בעת ביצוע חישובים, חשוב להשתמש בסטטיסטיקה המבוססת על קוונטיםמכניקה.
בהתבסס על היסודות של מכניקת הקוונטים, לכל מערכת של חלקיקים שמתנדנדים או מסתובבים, כולל מולקולות גז, יש רק כמה ערכים נפרדים של אנרגיה.
אם האנרגיה של תנועה תרמית במערכת אינה מספיקה כדי לעורר תנודות בתדר מסוים, תנועות כאלה אינן תורמות לקיבולת החום הכוללת של המערכת.
כתוצאה מכך, מידה מסוימת של חופש הופכת ל"קפואה", אי אפשר להחיל עליה את חוק השוויון.
קיבולת החום של גזים היא מאפיין חשוב של המצב שבו תלוי התפקוד של המערכת התרמודינמית כולה.
הטמפרטורה שבה ניתן להחיל את חוק השוויון על דרגת החופש הרטט או הסיבובית מאופיינת בתורת הקוונטים, מחברת את קבוע פלאנק עם קבוע בולצמן.

גזים דיאטומיים
הפערים בין רמות האנרגיה הסיבובית של גזים כאלה הם מספר קטן של מעלות. היוצא מן הכלל הוא מימן, שבו ערך הטמפרטורה נקבע במאות מעלות.
לכן קשה לתאר את קיבולת החום של גז בלחץ קבוע בחוק הפיזור האחיד. בסטטיסטיקה קוונטית, בקביעת קיבולת החום, לוקחים בחשבון שחלק הרטט שלו, במקרה של ירידה בטמפרטורה, יורד במהירות ומגיע לאפס.
תופעה זו מסבירה את העובדה שבטמפרטורת החדר אין כמעט חלק רטט מיכולת החום, עבורגז דיאטומי, הוא מתאים לקבוע R.
קיבולת החום של גז בנפח קבוע במקרה של מחווני טמפרטורה נמוכה נקבעת באמצעות סטטיסטיקה קוונטית. ישנו עקרון נרנסט, שנקרא החוק השלישי של התרמודינמיקה. בהתבסס על הניסוח שלו, קיבולת החום המולארית של גז תקטן עם ירידה בטמפרטורה, תוך נטייה לאפס.

תכונות של מוצקים
אם ניתן להסביר את קיבולת החום של תערובת גזים באמצעות סטטיסטיקה קוונטית, אז עבור מצב צבירה מוצק, תנועה תרמית מאופיינת בתנודות קלות של חלקיקים ליד מיקום שיווי המשקל.
לכל אטום שלוש דרגות רטט של חופש, לכן, בהתאם לחוק החלוקה השוויונית, ניתן לחשב את קיבולת החום המולארית של מוצק כ-3nR, כאשר n הוא מספר האטומים במולקולה.
בפועל, מספר זה הוא הגבול אליו נוטה קיבולת החום של גוף מוצק בטמפרטורות גבוהות.
ניתן להשיג מקסימום בטמפרטורות רגילות עבור אלמנטים מסוימים, כולל מתכות. עבור n=1, חוק Dulong ו-Petit מתקיים, אך עבור חומרים מורכבים די קשה להגיע לגבול כזה. מכיוון שלא ניתן להשיג את הגבול במציאות, מתרחש פירוק או התכה של המוצק.
היסטוריה של תורת הקוונטים
מייסדי תורת הקוונטים הם איינשטיין ודבי בתחילת המאה העשרים. זה מבוסס על קוונטיזציה של תנועות תנודות של אטומים בפרט מסויםגָבִישׁ. במקרה של אינדיקטורים לטמפרטורה נמוכה, מתברר כי קיבולת החום של גוף מוצק עומדת ביחס ישר לערך המוחלט שנלקח בקוביות. מערכת יחסים זו כונתה חוק דבי. כקריטריון המאפשר להבחין בין מדדי טמפרטורה נמוכה לגבוהה, נלקחת ההשוואה שלהם לטמפרטורת Debye.
ערך זה נקבע על ידי ספקטרום התנודות של אטום בגוף, לכן הוא תלוי מאוד בתכונות של מבנה הגביש שלו.
QD הוא ערך שיש לו כמה מאות K, אבל, למשל, הוא הרבה יותר גבוה ביהלום.
אלקטרוני ההולכה תורמים תרומה משמעותית ליכולת החום של מתכות. כדי לחשב אותו, נעשה שימוש בסטטיסטיקה הקוונטית של פרמי. המוליכות האלקטרונית של אטומי מתכת עומדת ביחס ישר לטמפרטורה המוחלטת. מכיוון שזהו ערך לא משמעותי, הוא נלקח בחשבון רק בטמפרטורות הנוטות לאפס המוחלט.
שיטות לקביעת קיבולת חום
שיטת הניסוי העיקרית היא קלורימטריה. כדי לבצע חישוב תיאורטי של קיבולת החום, נעשה שימוש בתרמודינמיקה סטטיסטית. זה תקף עבור גז אידיאלי, כמו גם עבור גופים גבישיים, מתבצע על בסיס נתונים ניסיוניים על מבנה החומר.
שיטות אמפיריות לחישוב קיבולת החום של גז אידיאלי מבוססות על הרעיון של המבנה הכימי, התרומה של קבוצות בודדות של אטומים ל-Ср.
לנוזלים משתמשים גם בשיטות המבוססות על שימוש בתרמודינמיתמחזורים המאפשרים לעבור מיכולת החום של גז אידיאלי לנוזל דרך הנגזרת של טמפרטורת האנטלפיה של תהליך האידוי.
במקרה של פתרון, חישוב קיבולת החום כפונקציה תוספתית אסור, שכן הערך העודף של קיבולת החום של התמיסה הוא משמעותי ביסודו.
כדי להעריך את זה, אנחנו צריכים את התיאוריה המולקולרית-סטטיסטית של פתרונות. הקשה ביותר הוא זיהוי יכולת החום של מערכות הטרוגניות בניתוח תרמודינמי.

מסקנה
המחקר של קיבולת החום מאפשר לך לחשב את מאזן האנרגיה של תהליכים המתרחשים בכורים כימיים, כמו גם במנגנוני ייצור כימיים אחרים. בנוסף, ערך זה נחוץ לבחירת סוגי נוזלי קירור אופטימליים.
כיום, הקביעה הניסיונית של קיבולת החום של חומרים עבור מרווחי טמפרטורות שונים - מערכים נמוכים לערכים גבוהים - היא האפשרות העיקרית לקביעת המאפיינים התרמודינמיים של חומר. בעת חישוב האנטרופיה והאנטלפיה של חומר, נעשה שימוש באינטגרלי קיבולת חום. מידע על קיבולת החום של ריאגנטים כימיים בטווח טמפרטורות מסוים מאפשר לך לחשב את ההשפעה התרמית של התהליך. מידע על קיבולת החום של פתרונות מאפשר לחשב את הפרמטרים התרמודינמיים שלהם בכל ערכי טמפרטורה בתוך המרווח המנותח.
לדוגמה, נוזל מאופיין בהוצאה של חלק מהחום כדי לשנות את ערך האנרגיה הפוטנציאליתמולקולות מגיבות. ערך זה נקרא קיבולת החום "תצורה", המשמשת לתיאור פתרונות.
קשה לערוך חישובים מתמטיים מלאים מבלי לקחת בחשבון את המאפיינים התרמודינמיים של חומר, מצב הצבירה שלו. לכן עבור נוזלים, גזים, מוצקים משתמשים במאפיין כמו קיבולת חום ספציפית, המאפשר לאפיין את פרמטרי האנרגיה של חומר.






