כל אדם במהלך חייו נתקל בגופים שנמצאים באחד משלושת המצבים המצטברים של החומר. מצב הצבירה הפשוט ביותר למחקר הוא גז. במאמר, נשקול את המושג של גז אידיאלי, נביא את משוואת המצב של המערכת, ונשים לב גם לתיאור הטמפרטורה המוחלטת.
מצב הגז של החומר
לכל תלמיד יש מושג טוב על איזה מצב חומר הוא מדבר כאשר הוא שומע את המילה "גז". מילה זו מובנת כגוף המסוגל לתפוס כל נפח שניתן לו. הוא לא מסוגל לשמור על צורתו, כי הוא לא יכול להתנגד אפילו להשפעה חיצונית הקטנה ביותר. כמו כן, גז אינו שומר על נפח, מה שמבדיל אותו לא רק ממוצקים, אלא גם מנוזלים.
כמו נוזל, גז הוא חומר נוזלי. בתהליך התנועה של גופים מוצקים בגזים, האחרונים מעכבים תנועה זו. הכוח שנוצר נקרא התנגדות. ערכו תלוי במהירות הגוף בגז.
דוגמאות חזקות לגזים הן אוויר, גז טבעי המשמש לחימום בתים ובישול, גזים אינרטיים (Ne, Ar) המשמשים למילוי צינורות זוהר פרסומיים או משמשים ליצירת סביבה אינרטית (לא תוקפנית, מגינה) בעת ריתוך.
גז אידיאלי
לפני שתמשיך לתיאור חוקי הגז ולמשוואת המדינה, עליך להבין היטב את השאלה מהו גז אידיאלי. מושג זה מוצג בתיאוריה קינטית מולקולרית (MKT). גז אידיאלי הוא כל גז שעונה על המאפיינים הבאים:
- החלקיקים היוצרים אותו אינם מקיימים אינטראקציה זה עם זה למעט התנגשויות מכניות ישירות.
- כתוצאה מהתנגשות של חלקיקים בדפנות הכלי או בינם לבין עצמם, האנרגיה הקינטית והתנע שלהם נשמרים, כלומר, ההתנגשות נחשבת אלסטית לחלוטין.
- לחלקיקים אין ממדים, אבל יש להם מסה סופית, כלומר, הם דומים לנקודות חומריות.
זה טבעי שכל גז הוא לא אידיאלי, אלא אמיתי. עם זאת, לפתרון בעיות מעשיות רבות, קירובים אלה תקפים למדי וניתן להשתמש בהם. יש כלל אמפירי כללי שאומר: ללא קשר לאופי הכימי, אם לגז יש טמפרטורה מעל טמפרטורת החדר ולחץ בסדר גודל של אטמוספרי או נמוך יותר, אזי הוא יכול להיחשב אידיאלי עם דיוק גבוה וניתן להשתמש בו לתיאור זה.נוסחה של משוואת הגז האידיאלית של המדינה.
חוק קלפיירון-מנדלייב
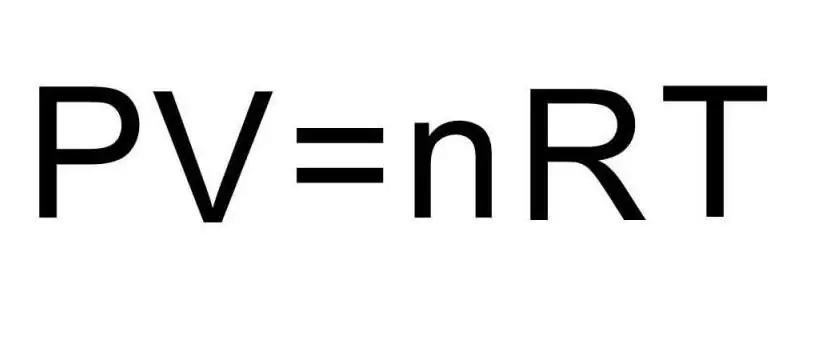
מעברים בין מצבים מצטברים שונים של חומר ותהליכים בתוך מצב צבירה בודד מטופלים על ידי תרמודינמיקה. לחץ, טמפרטורה ונפח הם שלוש כמויות שמגדירות באופן ייחודי כל מצב של מערכת תרמודינמית. הנוסחה למשוואת המצב של גז אידיאלי משלבת את כל שלושת הכמויות הללו לכדי שוויון אחד. בוא נכתוב את הנוסחה הזו:
PV=nRT
כאן P, V, T - לחץ, נפח, טמפרטורה, בהתאמה. הערך של n הוא כמות החומר בשומות, והסמל R מציין את הקבוע האוניברסלי של גזים. שוויון זה מראה שככל שהמכפלה של לחץ ונפח גדול יותר, כך חייב להיות המכפלה של כמות החומר והטמפרטורה גדול יותר.

הנוסחה למשוואת המצב של גז נקראת חוק קלפיירון-מנדלייב. בשנת 1834 הגיע המדען הצרפתי אמיל קלפיירון, שסיכם את תוצאות הניסוי של קודמיו, למשוואה זו. עם זאת, קלפיירון השתמש במספר קבועים, שמנדלייב החליף מאוחר יותר באחד - קבוע הגז האוניברסלי R (8, 314 J / (מולK)). לכן, בפיזיקה המודרנית, משוואה זו נקראת על שם שמות של מדענים צרפתים ורוסים.

טפסי משוואה אחרים
למעלה, כתבנו את משוואת המדינה מנדלייב-קלפיירון עבור גז אידיאלי במקובל ובצורה נוחה. עם זאת, בבעיות בתרמודינמיקה, לעתים קרובות תידרש צורה מעט שונה. להלן נכתבות שלוש נוסחאות נוספות, הנובעות ישירות מהמשוואה הכתובה:
PV=NkBT;
PV=m/MRT;
P=ρRT/M.
שלוש המשוואות הללו הן גם אוניברסליות עבור גז אידיאלי, רק שבהן מופיעות כמויות כמו מסה m, מסה מולרית M, צפיפות ρ ומספר החלקיקים N המרכיבים את המערכת. הסמל kB כאן מציין את קבוע בולצמן (1, 3810-23J/K).
חוק בויל-מריוט
כשקלפיירון ערך את המשוואה שלו, הוא התבסס על חוקי גז שהתגלו בניסוי כמה עשורים קודם לכן. אחד מהם הוא חוק בויל-מריוט. הוא משקף תהליך איזותרמי במערכת סגורה, וכתוצאה מכך משתנים פרמטרים מקרוסקופיים כמו לחץ ונפח. אם נשים T ו-n קבועים במשוואת המצב עבור גז אידיאלי, אז חוק הגז יקבל את הצורה:
P1V1=P2V 2
זהו חוק בויל-מריוט, שאומר שתוצר הלחץ והנפח נשמר במהלך תהליך איזותרמי שרירותי. במקרה זה, הערכים P ו-V עצמם משתנים.
אם אתה מתווה P(V) או V(P), אזי האיזותרמיות יהיו היפרבולות.
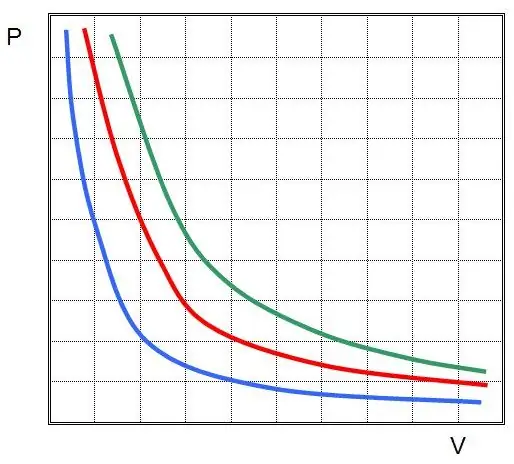
חוקי צ'ארלס וגיי-לוסאק
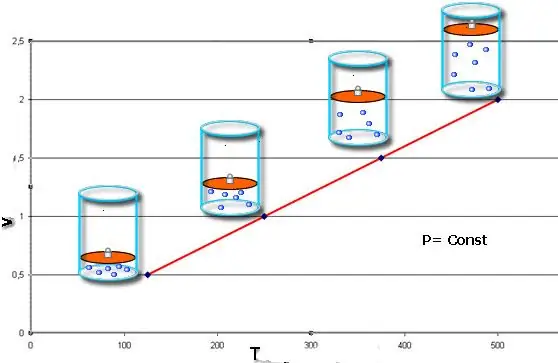
חוקים אלה מתארים מתמטית איזוברית ואיזוכוריתתהליכים, כלומר מעברים כאלה בין מצבי מערכת הגז, בהם נשמרים לחץ ונפח, בהתאמה. ניתן לכתוב את חוק צ'ארלס באופן מתמטי באופן הבא:
V/T=const כאשר n, P=const.
חוק Gay-Lussac כתוב כך:
P/T=const כאשר n, V=const.
אם שני השוויון מוצגים בצורה של גרף, אז נקבל קווים ישרים שנוטים בזווית כלשהי לציר ה-x. סוג זה של גרף מצביע על מידתיות ישירה בין נפח וטמפרטורה בלחץ קבוע ובין לחץ לטמפרטורה בנפח קבוע.
שימו לב שכל שלושת חוקי הגז הנחשבים אינם לוקחים בחשבון את ההרכב הכימי של הגז, כמו גם את השינוי בכמות החומר שלו.
טמפרטורה אבסולוטית
בחיי היום-יום אנו רגילים להשתמש בסולם טמפרטורות צלזיוס, שכן הוא נוח לתיאור התהליכים סביבנו. אז, מים רותחים ב-100 oC וקופאים ב-0 oC. בפיזיקה, סולם זה מתברר כלא נוח, ולכן נעשה שימוש בסולם הטמפרטורה המוחלט, אשר הוצג על ידי לורד קלווין באמצע המאה ה-19. בהתאם לסולם זה, הטמפרטורה נמדדת בקלווין (K).
מאמינים שבטמפרטורה של -273, 15 oC אין רעידות תרמיות של אטומים ומולקולות, תנועתם קדימה נעצרת לחלוטין. טמפרטורה זו במעלות צלזיוס מתאימה לאפס המוחלט בקלווין (0 K). מהגדרה זוהמשמעות הפיזיקלית של הטמפרטורה המוחלטת היא: זוהי מדד לאנרגיה הקינטית של החלקיקים המרכיבים את החומר, למשל, אטומים או מולקולות.
מלבד המשמעות הפיזיקלית שלעיל של טמפרטורה מוחלטת, ישנן גישות אחרות להבנת כמות זו. אחד מהם הוא חוק הגז המוזכר של צ'ארלס. בוא נכתוב את זה בצורה הבאה:
V1/T1=V2/T 2=>
V1/V2=T1/T 2.
השוויון האחרון אומר שבכמות מסוימת של חומר במערכת (לדוגמה, 1 מול) ולחץ מסוים (לדוגמה, 1 Pa), נפח הגז קובע באופן ייחודי את הטמפרטורה המוחלטת. במילים אחרות, עלייה בנפח הגז בתנאים אלו אפשרית רק עקב עלייה בטמפרטורה, וירידה בנפח מצביעה על ירידה בערך של T.
זכור שבניגוד לטמפרטורה של צלזיוס, הטמפרטורה המוחלטת לא יכולה להיות שלילית.
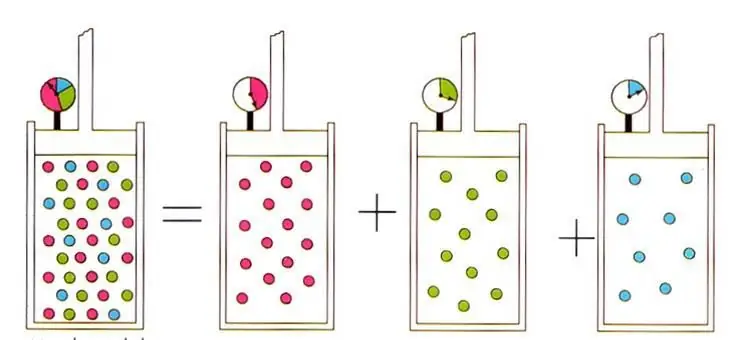
עקרון אבוגדרו ותערובות גז
בנוסף לחוקי הגז הנ ל, משוואת המדינה לגז אידיאלי מובילה גם לעיקרון שגילה אמדאו אבוגדרו בתחילת המאה ה-19, הנושא את שם משפחתו. עקרון זה קובע שנפח כל גז בלחץ וטמפרטורה קבועים נקבע על פי כמות החומר במערכת. הנוסחה המתאימה נראית כך:
n/V=const כאשר P, T=const.
הביטוי הכתוב מוביל לחוק הידוע בפיזיקת הגז האידיאלית של דלטון לתערובות גזים. זֶההחוק קובע שהלחץ החלקי של גז בתערובת נקבע באופן ייחודי על ידי השבר האטומי שלו.
דוגמה לפתרון בעיות
בכלי סגור עם קירות קשיחים המכיל גז אידיאלי, כתוצאה מחימום, הלחץ עלה פי 3. יש צורך לקבוע את הטמפרטורה הסופית של המערכת אם הערך ההתחלתי שלה היה 25 oC.
ראשית, בואו נמיר את הטמפרטורה ממעלות צלזיוס לקלווין, יש לנו:
T=25 + 273, 15=298, 15 K.
מכיוון שקירות הכלי קשיחים, תהליך החימום יכול להיחשב איזוכורי. במקרה זה, אנו מיישמים את חוק Gay-Lussac, יש לנו:
P1/T1=P2/T 2=>
T2=P2/P1T 1.
לפיכך, הטמפרטורה הסופית נקבעת מהמכפלה של יחס הלחץ והטמפרטורה ההתחלתית. החלפת הנתונים לשוויון, נקבל את התשובה: T2=894.45 K. טמפרטורה זו מתאימה ל-621.3 oC.






